Petra Kisselová, Paul Plane, Ján Mikuláš, Erika Kajdácsi, George Sinkovits, László Červenák & Zoltán Prohászka
Abstrakt
Očkovanie proti SARS-CoV-2 znižuje riziko vzniku závažného ochorenia COVID-19. Monitorovanie hladín podtriedy IgG špecifických pre hroty po očkovaní môže poskytnúť ďalšie informácie o humorálnej imunitnej odpovedi špecifickej pre SARS-CoV-2. Tu sme skúmali prítomnosť a hladiny podtried protilátok IgG špecifických pre hroty u zdravotníckych spolupracovníkov očkovaných vektorovými (Sputnik, AstraZeneca) alebo mRNA (Pfizer-BioNTech, Moderna) vakcínami proti SARS-CoV-2 a u neočkovaných pacientov s COVID-19. Zistili sme, že vakcíny na báze vektorov vyvolali nižšie celkové hladiny IgG špecifické pre hroty ako vakcíny mRNA. Vzor podtried IgG špecifických pre hroty u jedincov infikovaných pred očkovaním mRNA sa podobal vzoru vektorovo očkovaných subjektov alebo neočkovaných pacientov s COVID-19. Vzor jedincov očkovaných mRNA bez preinfekcie SARS-CoV-2 však ukázal výrazne odlišný vzorec. Okrem podtried IgG1 a IgG3 prezentovaných vo všetkých skupinách sa prechod na distálne podtriedy IgG (IgG4 a IgG2 špecifický pre hroty) objavil takmer výlučne u jedincov, ktorí dostali iba vakcíny mRNA alebo boli infikovaní po očkovaní mRNA. U týchto jedincov bola veľkosť reakcie IgG4 špecifickej pre hroty porovnateľná s veľkosťou odpovede IgG1 špecifickej pre hrot. Tieto údaje naznačujú, že priming imunitného systému buď prirodzenou infekciou SARS-CoV-2 alebo očkovaním na báze vektorov alebo mRNA má významný vplyv na charakteristiky vyvinutej špecifickej humorálnej imunity.
Úvod
Podľa klinických štúdií je očkovanie proti koronavírusu 2 spôsobujúcemu ťažký akútny respiračný syndróm (SARS-CoV-2) najúčinnejšou stratégiou prevencie závažného ochorenia COVID-191. Zavedené metódy očkovania sú rôznorodé, ale všetky vedú k imunite proti spike proteínu SARS-CoV-2. Vo väčšine krajín sú k dispozícii rôzne vakcíny. Najpoužívanejšie typy vakcín proti SARS-CoV-2 siahajú od inaktivovaných vakcín až po nereplikujúce sa vakcíny na báze vírusového vektora a nedávno predstavené vakcíny mRNA2. Pokiaľ ide o primárne imunizácie, v Maďarsku boli zavedené vakcíny mRNA, ako sú BNT162b2 od spoločností Pfizer-BioNTech (ďalej len Pfizer-BioNTech) a mRNA-1273 od spoločnosti Moderna (ďalej len Moderna), vakcíny na báze vektorov, ako sú ChAdOx-1 od spoločnosti AstraZeneca (ďalej len AstraZeneca), Sputnik V od spoločnosti Gamaleya (ďalej len Sputnik), Janssen od spoločnosti Johnson&Johnson (ďalej len “Janssen”) a inaktivované vakcíny ako BBIBP-CorV od spoločnosti Sinopharm (ďalej len “Sinopharm”), kde bolo do konca úplne zaočkovaných 61,6 % celkovej populácie z decembra 20213.
Je už známe, že jedinci predtým neliečení SARS-CoV-2 a predtým infikovaní jedinci vykazujú odlišné imunitné odpovede na očkovanie mRNA. U predtým neliečených jedincov sa odpoveď T buniek zvyšuje po druhej dávke vakcíny Pfizer-BioNTech, zatiaľ čo osoby, ktoré prekonali COVID-19, dosiahli najvyššie hladiny po prvej dávke4. Podobné výsledky sa zistili pre protilátkovú odpoveď špecifickú pre hrot; predtým infikovaní jedinci dosiahli podobné špecifické hladiny protilátok po prvom očkovaní ako neinfikovaní jedinci po druhej dávke vakcíny5. Po očkovaní na základe vektorov sa hladina neutralizačných protilátok odvodených z pamäťových B buniek zdala byť významne nižšia u príjemcov Sputnika ako u pacientov zotavujúcich sa z COVID-196. Okrem toho boli rôzne množstvá a kvalita CD4+ T buniek, CD8+ T buniek a protilátkových odpovedí indukovaných vakcínami na báze mRNA (Moderna a Pfizer-BioNTech), vektormi (Janssen) a proteínmi (Novavax). V tejto štúdii sa ukázalo, že vakcíny mRNA sú najviac imunogénne z hľadiska odpovedí špecifických pre antigén, hoci pokles titrov neutralizačných protilátok bol preukázaný po 6 mesiacoch7. Na udržanie vysokých špecifických hladín protilátok bolo do augusta 2021 zavedené posilňovacie očkovanie a 32,7% celej populácie v Maďarsku dostalo aspoň jednu dávku posilňovacej vakcíny. Ako posilňovacie vakcíny boli použité Pfizer-BioNTech, Moderna, AstraZeneca, Janssen alebo Sinopharm3.
Najrozšírenejším izotypom imunoglobulínu v ľudskom sére je imunoglobulín G (IgG). Jeho podtriedy sú vysoko konzervované, ale líšia sa v ich konštantných oblastiach. Každá podtrieda má jedinečný profil z hľadiska väzby na antigén, tvorby imunitného komplexu, aktivácie komplementu a spustenia aktivácie efektorových buniek. Po antigénnych podnetoch, IgG3 a IgG1, sa najprv vylučujú dve hlavné podtriedy aktivujúce komplement, zatiaľ čo IgG2 a IgG4, ktoré sa tvoria neskôr, môžu hrať úlohu pri zmierňovaní zápalu kvôli ich neschopnosti aktivovať komplement8. Je známe, že protilátkové odpovede na antigény vírusových proteínov sú obmedzené hlavne na IgG1 a IgG39,10. IgG2 je stimulovaný primárne sacharidovými antigénmi, zatiaľ čo IgG4 sa produkuje ako odpoveď na helminthické infekcie alebo na predĺžené stimulácie antigénom8. Podtriedy IgG produkované proti proteínovým antigénom však závisia od iných faktorov, ako je typ patogénov, ako je odpoveď T-pomocných buniek a cesta a miesto infekcií11.
V imunologickom výskume SARS-CoV-2 nebol úplne preskúmaný vzťah medzi špecifickým titrom IgG a odpoveďou na vyvolanie pamäte12,13. Údaje o jednobunkovom sekvenovaní a prietokovej cytometrii nedávno ukázali značné populácie B-buniek s prepnutou IgG4 viažucou pamäť B buniek po očkovaní mRNA14. Ďalšia štúdia odhalila, že vakcíny na báze adenovírusu nevyvolali dlhodobú odpoveď IgG4 špecifickú pre hroty15. Na charakterizáciu izotypov a podtried protilátok generovaných v reakcii na rôzne očkovania a prirodzené infekcie SARS-CoV-2 sú potrebné ďalšie štúdie.
Ciele
V tejto štúdii sme skúmali, či infekcia SARS-CoV-2 a očkovanie (rôznymi typmi vakcín) vyvolali podobný vzorec podtriedy IgG špecifický pre hroty a či tieto vzorce boli ovplyvnené chronologickým poradím prirodzenej vírusovej infekcie a očkovania alebo nie. Zamerali sme sa tiež na monitorovanie koncentrácie každej podtriedy IgG špecifickej pre hroty v období troch až štyroch mesiacov, aby sme odhadli stabilitu antivírusovej humorálnej imunitnej odpovede. Porovnanie hladín IgG podtried špecifických pre hroty po očkovaní a infekcii môže poskytnúť pohľad na mechanizmy, ktoré riadia protilátkovú odpoveď v oboch podmienkach.
Výsledky
Kohorty očkovaných a COVID-19
Prijali sme 47 zdravých dobrovoľníkov pre očkovanú kohortu v Budapešti v Maďarsku. Z nich 36 osôb (medián veku = 41 IQR [32–51]); 64 % žien) bolo očkovaných mRNA vakcínami (Pfizer-BioNTech alebo Moderna) a 11 (medián veku = 51 IQR [43–57]); 45% žien) vektorovými vakcínami (Sputnik alebo AstraZeneca). Vzorky séra boli odobraté v medián dňa 128 IQR [100–157] po posilňovacej vakcinácii. Kohorta COVID-19 zahŕňala vzorky séra od rekonvalescentných účastníkov (medián veku = 45 IQR [34–55]); 41 % žien) a hospitalizovaných pacientov (medián veku = 69 IQR [58 – 78]); 39 % žien) užívaných v mediáne dní 54 IQR [45–64] po infekcii a 21 IQR [9–41] po infekcii. (Obr. 1, tabuľka1).
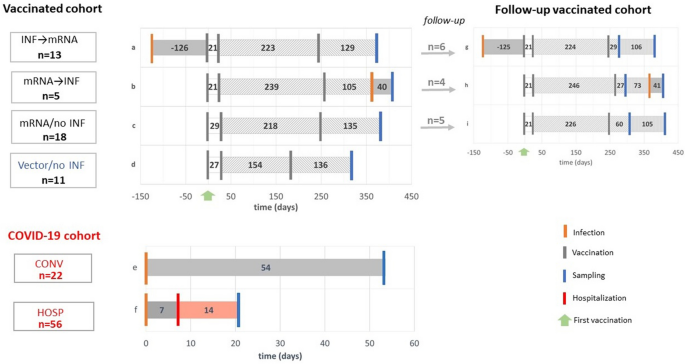
Tabuľka 1 Demografické údaje očkovaných kohort a kohort COVID-19.
Okrem toho sme pozdĺžne monitorovali 15 dobrovoľníkov očkovaných mRNA v dvoch časových bodoch po ich posilňovacej vakcinácii v mediáne dní 37 IQR [20–60] a 160 IQR [125–173] (obr. 1). Demografické charakteristiky kohort sú podrobnejšie opísané v tabuľkách 1 a 2.Tabuľka 2 Charakteristika sledovaných jedincov.
Hladiny celkového IgG špecifického pre hroty a celkového sérového IgG v očkovanej kohorte po primárnom a posilňovacom očkovaní a v kohorte COVID-19
Po prvé, v našich očkovaných kohortách a kohortách COVID-19 boli kvantifikované celkové IgG protilátky špecifické pre hroty a celkové sérové IgG protilátky. Očkovanie na báze mRNA viedlo k vyšším celkovým hladinám IgG špecifických pre hroty ako pri neinfikovaných vektorových očkovaniach (Kruskal–Wallis ANOVA, p < 0,0001). Aj keď rozdiely medzi skupinou mRNA / no INF a infikovanou skupinou mRNA (INF → mRNA, mRNA → INF) neboli významné, existuje trend vyšších celkových hladín IgG špecifických pre hroty v infikovaných skupinách mRNA. Nedostatok významu je možno spôsobený malými veľkosťami vzoriek. Podobne ako v skupine Vector/no INF sme v kohorte COVID-19 zistili nízke celkové hladiny IgG špecifické pre špičky. Celkové sérové hladiny IgG boli vo fyziologickom rozmedzí a nepreukázali žiadne významné rozdiely medzi testovanými skupinami (obr. 2).
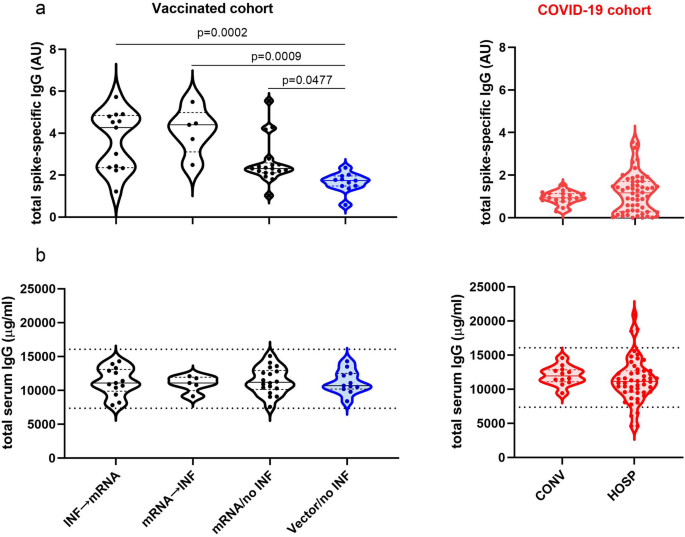
Distribúcia protilátok IgG špecifických pre hroty a celkového množstva sérových IgG protilátok v podtriede v očkovanej kohorte po primárnom a posilňovacom očkovaní a v kohorte COVID-19
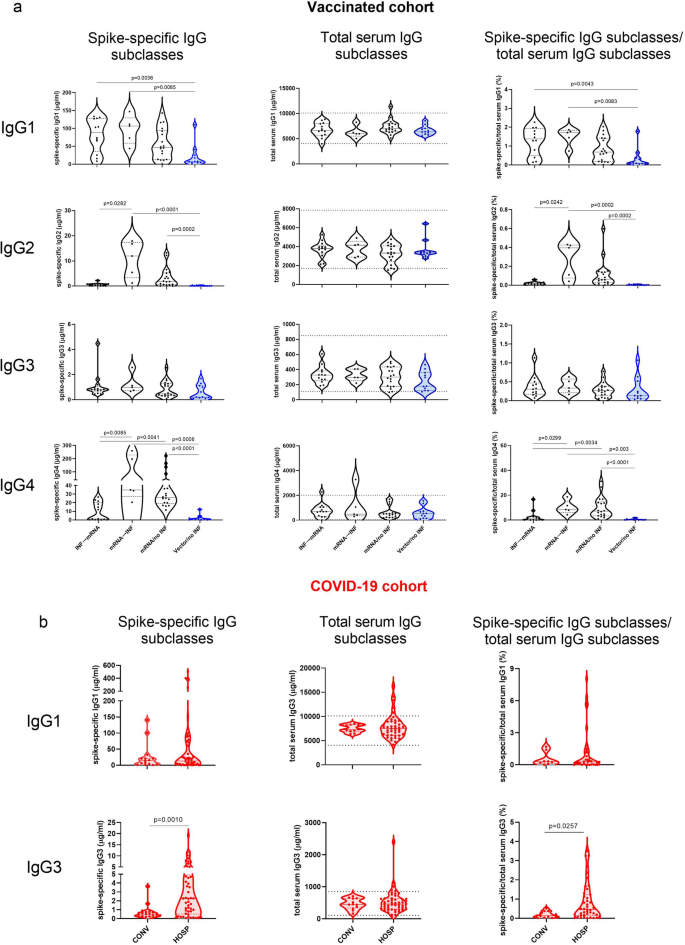
Jedinci infikovaní aj očkovaní primárnymi vakcínami mRNA (mRNA → INF, INF → mRNA) mali vysoké hladiny IgG1 špecifického pre hroty, bez ohľadu na čas infekcie COVID-19. Ich hladiny IgG1 špecifické pre hroty boli vyššie ako hladiny jedincov s vektorom/žiadnym INF a podobné trendy boli pozorované v porovnaní so skupinou mRNA/no INF. Hoci podtrieda IgG3 špecifická pre hroty bola jednou z dominantných špecifických podtried IgG u pacientov s COVID-19, nenašli sme žiadne podstatné rozdiely v hladinách IgG3 špecifických pre hroty meraných v našich očkovaných skupinách. Je zaujímavé, že vysoké hladiny IgG2 a IgG4 špecifické pre hroty boli merané u jedincov, ktorí dostali vakcíny mRNA ako prvé (mRNA → INF, mRNA / bez INF), bez ohľadu na to, či boli infikovaní po očkovaní alebo nie. Okrem toho, IgG4 špecifický pre hroty bol hlavným príspevkom k celkovým úrovniam IgG4. Ich podiely boli okolo 10% v skupinách mRNA → INF a mRNA / no INF, čo ďaleko prevyšuje pomery, ktoré sme zistili v iných podtriedach. Všetky celkové sérové podtriedy IgG boli merané v očkovanej kohorte. V kohorte COVID-19 neboli zistené podtriedy IgG2 a IgG4 špecifické pre hroty, preto sme v tejto kohorte merali iba celkové sérové podtriedy IgG1 a IgG3. Predovšetkým sme nenašli žiadne významné rozdiely medzi hladinami celkovej podtriedy IgG protilátok v sére (obr. 3).
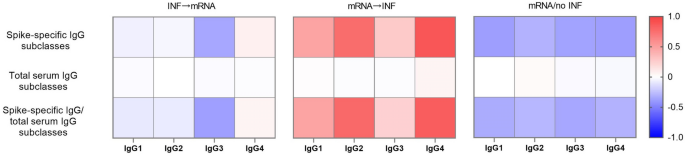
Teplotné mapy podtriedy protilátok IgG špecifických pre hroty a celkové sérové hladiny protilátok v následnej očkovanej kohorte
Vizualizácie teplotných máp boli vykonané logaritmickými hodnotami priemernej zmeny záhybu v podtriede IgG špecifickej pre hroty a celkových sérových hladinách IgG medzi dvoma časovými bodmi odberu vzoriek po posilňovacej vakcinácii. Subjekty v skupine INF → mRNA vykazovali znížené hladiny IgG3 špecifického pre hroty a konštantné hladiny IgG1, IgG2 a IgG4 špecifických pre hroty. Jedinci v skupine mRNA → INF mali zvyšujúce sa hladiny IgG1, IgG2 a IgG4 špecifické pre hroty. Koncentrácia IgG3 špecifického pre hroty bola mierne zvýšená medzi dvoma časovými bodmi odberu vzoriek, jej hladina však bola len okolo 1 μg/ml. Hladiny IgG1 a IgG3 špecifických pre hroty sa znížili u jedincov v skupine mRNA/no INF. Okrem toho sa zistili klesajúce trendy v podtriedach protilátok IgG2 a IgG4 špecifických pre hroty. Každá sérová podtrieda IgG protilátok vykazovala konštantnú hladinu vo všetkých očkovaných skupinách počas obdobia troch až štyroch mesiacov. Keďže koncentrácia každej celkovej sérovej podtriedy IgG zostala stabilná, pomer úrovne každej podtriedy IgG špecifickej pre hroty k úrovni celkovej sérovej podtriedy IgG sa počas sledovaného obdobia menil podobne ako podtriedy IgG špecifické pre hroty. To dokazuje, že očkovanie mRNA nezávisle od infekcií SARS-CoV-2 nezmenilo distribúciu celkovej sérovej podtriedy IgG (obr. 4). Podtriedy protilátok IgG špecifických pre hroty a celkové sérové hladiny protilátok IgG sú uvedené v následných skupinách očkovaných mRNA medzi dvoma časovými bodmi odberu vzoriek (obr. S4).
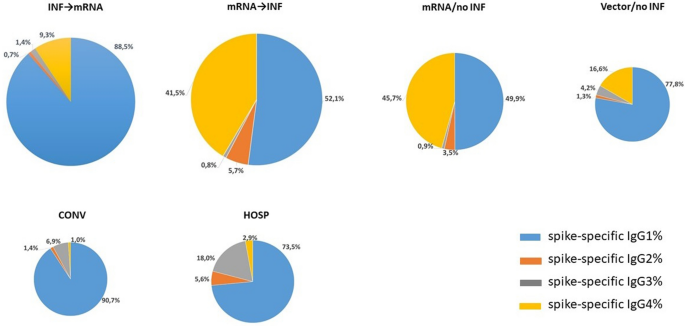
Úrovne podtried IgG špecifických pre hroty vyjadrené v percentách všetkých protilátok IgG špecifických pre hroty
Percentuálne podiely IgG4 špecifického pre hroty boli vyššie v očkovaných skupinách ako v skupinách kohorty COVID-19. Podiel podtriedy IgG4 špecifickej pre hroty k súčtu všetkých protilátok IgG špecifických pre hroty bol medzi 1 a 3 % v skupine CONV a HOSP. V očkovaných skupinách sme zistili 16,6% IgG4 špecifického pre hroty v skupine Vector/no INF, zatiaľ čo jeho hodnoty boli až 41,5% a 45,7% v skupinách mRNA → INF a mRNA/no INF (obr. 5).
Diskusia
V posledných rokoch bolo zavedených niekoľko rôznych platforiem vakcín na kontrolu ochorenia COVID-192,7. Ich naliehavé zavedenie však neuľahčilo charakterizáciu ich mechanizmu účinku16.
Tu sme mali jedinečnú príležitosť porovnať humorálne imunitné odpovede vyvolané nereplikujúcimi sa adenovírusovými (Ad) vektorovými (AstraZeneca, Sputnik) a mRNA (Pfizer-BioNTech a Moderna) vakcínovými platformami založenými na DNA. V tejto štúdii sme určili hladiny celkového IgG špecifického pre hroty a celkového sérového IgG v našich očkovaných kohortách a kohortách COVID-19. Jedinci očkovaní vektorovými vakcínami mali približne štyri až päť mesiacov po posilňovacom očkovaní nižšie celkové hladiny IgG špecifické pre hroty ako subjekty s vakcínami mRNA. Hoogen et al. tiež preukázali vyššie hladiny protilátok špecifických pre S1 po očkovaní vakcínami na báze mRNA ako vakcíny na báze vektorov vo všeobecnej populácii v Holandsku17. Okrem toho boli zistené nízke celkové hladiny protilátok špecifických pre hroty v našich skupinách rekonvalescentov a akútnych pacientov kohorty COVID-19. Podobné výsledky boli hlásené, že sérové hladiny IgG špecifického pre hroty SARS-CoV-2 boli u očkovaných jedincov 5,6-krát vyššie ako u infikovaných pacientov18. Namerané celkové sérové hladiny IgG zodpovedali normálnym sérovým hladinám a medzi našimi skúmanými skupinami sme nenašli žiadne významné rozdiely19. Vzor podtried IgG špecifických pre hroty u jedincov, ktorí boli infikovaní pred očkovaním mRNA, bol podobný ako u subjektov, ktoré dostali vektorové vakcíny, alebo u pacientov s COVID-19, ktorí nedostali žiadne vakcíny. U našich pacientov s COVID-19 boli podtriedy protilátok IgG1 a IgG3 špecifické pre hroty dominantne prítomné v mediáne 21 dní po infekcii. Niekoľko správ tiež ukázalo, že dominantnými podtriedami u pacientov s COVID-19 boli IgG1 a IgG3 špecifické pre hroty20. Tu možno prevahu IgG3 pri infekcii SARS-CoV-2 vysvetliť skutočnosťou, že vo všeobecnosti sa IgG3 objavuje skoro pri vírusových infekciách, pretože je kódovaný v najhornejšej (5ʹ) konštante (C) γ oblasti génového lokusu ťažkého reťazca imunoglobulínu na chromozóme 14 a vyvoláva aktiváciu klasickej komplementovej dráhy. Ďalšie rekombinácie prepínačov tried sledujú jednosmerný smer podtriedy IgG3 → IgG1 → IgG2 → IgG421,22. Zistili sme, že vzor podtried IgG špecifických pre hroty bol výrazne odlišný u jedincov očkovaných mRNA s predchádzajúcou infekciou SARS-CoV-2 alebo bez nej. Ďalší prechod na distálne podtriedy IgG (IgG4 špecifický pre hroty a stredne ťažký IgG2 špecifický pre hroty) sa vyskytol takmer výlučne u jedincov, ktorí dostali iba vakcíny mRNA alebo ktorí mali infekciu SARS-CoV-2 po očkovaní mRNA. Je zaujímavé, že u jedincov, ktorí zažili prelomovú infekciu neskôr ako 3 mesiace po posilňovacej vakcinácii, bolo pozorované výrazné zvýšenie titrov protilátok IgG2 a IgG4 špecifických pre hroty po 40 dňoch po ich prelomovej infekcii. Okrem toho sme tiež dokázali, že jedinci, ktorí boli infikovaní SARS-CoV-2 pred základným očkovaním mRNA, mali nižšie a konštantné hladiny IgG2 a IgG4 špecifické pre hroty v porovnaní s inými skupinami očkovania mRNA v časovom bode neskôr ako 4 mesiace po ich posilňovacom očkovaní. Podobne ako naše výsledky, Irrgang et al. tiež ukázali, že najvyššie hladiny IgG4 špecifické pre hroty boli zistené u jedincov, ktorí zažili prelomovú infekciu, ku ktorej došlo neskôr ako 3 mesiace po ich druhej imunizácii vakcínami mRNA14. Buhre et al. tiež potvrdili, že opakovaná imunizácia naivných jedincov mRNA vakcínami časom zvýšila podiel podtriedy IgG4 špecifickej pre hroty15. Okrem toho sme zistili nízke koncentrácie IgG4 špecifické pre hroty u jedincov, ktorí boli infikovaní pred očkovaním mRNA. Tieto výsledky sú v súlade so zisteniami Buhre et al., že primárna imunizácia mRNA s preinfekciou vyvolala malé alebo žiadne dlhodobé odpovede IgG4 špecifické pre hroty. Je pozoruhodné, že naša skupina očkovaná vektorovými vakcínami AstraZeneca a Sputnik nepreukázala dlhodobé reakcie IgG2 a IgG4 špecifické pre hroty. Podobné zistenia boli preukázané aj vo vyššie uvedených dvoch nezávislých štúdiách14,15. Dlhovekosť ochrannej humorálnej imunity závisí hlavne od generovania pamäťových B buniek a plazmatických buniek s dlhou životnosťou (LLPC)23. Rôzne cytokínové prostredie a interakcie medzi B a T bunkami môžu prispieť k vzniku rôznych izotypovo prepínaných pamäťových B buniek alebo LLPC24. Napríklad rôzne cytokínové profily boli opísané po rôznych typoch očkovania proti čiernemu kašľu Bordetella. Celobunkové očkovanie proti čiernemu kašľu bolo charakterizované zvýšenou produkciou cytokínov T-pomocných buniek typu 1, ako sú IFNγ alebo IL-2. Acelulárne vakcíny proti čiernemu kašľu indukovali zmiešaný cytokínový profil vykazovali zvýšenú produkciu IFN-γ (spojenú s IL-2), nízku produkciu IL-4 a hojnejšiu produkciu IL-525. Zloženie vakcíny môže tiež hrať úlohu pri indukcii špecifickej podtriedy IgG4. Tento mechanizmus ešte nie je jasne pochopený, ale pretrvávajúca odpoveď GC vyvolaná vakcínami na báze mRNA SARS-CoV-2 by mohla byť uskutočniteľným vysvetlením pri generovaní plazmatických buniek kostnej drene s dlhou životnosťou s podtriedou IgG4 14,26.
Vo všetkých očkovacích skupinách sa u jedincov vyvinuli protilátky IgG1 a IgG3 špecifické pre hroty, nezávisle od ich predchádzajúcej anamnézy infekcie. Pozoruhodné je, že v našej očkovanej kohorte sme pozorovali vyššie hladiny IgG1 špecifického pre hroty u zdravých dobrovoľníkov, ktorí boli infikovaní pred alebo po očkovaní mRNA, ako u tých, ktorí boli očkovaní vektorovými vakcínami. V súlade s krátkym polčasom IgG3 boli hladiny IgG3 špecifické pre hroty nízke v očkovaných skupinách a nelíšili sa u zdravých jedincov.
Ďalším cieľom našej štúdie bolo sledovať zmeny podtried IgG špecifických pre hroty počas obdobia 3 až 4 mesiacov po treťom posilňovacom očkovaní. V skupine mRNA → INF boli pozorované zvýšené odpovede IgG1, IgG2 a IgG4 špecifické pre hroty, čo naznačuje typickú odpoveď na vyvolanie pamäťových B buniek. Naproti tomu koncentrácie IgG1, IgG2 a IgG4 špecifické pre hroty klesli v skupine mRNA/no INF a boli pomerne konštantné v skupine INF → mRNA. Odlišné správanie IgG3 špecifického pre hroty od správania ostatných podtried IgG možno vysvetliť krátkym polčasom rozpadu IgG3. Celkové sérové hladiny IgG sa nezmenili počas nasledujúcich časových intervalov v skupinách očkovaných mRNA. Mali sme však určité obmedzenia v prvých časových bodoch odberu vzoriek po posilňovacích očkovaniach. V skupine s následným sledovaním mRNA/no INF bol prvý časový bod odberu vzoriek o 31 a 33 dní neskôr ako v skupinách INF → mRNA a mRNA → INF.
Ešte dôležitejšie je, že percentá IgG4 špecifického pre hroty k súčtu všetkých podtried IgG špecifických pre hroty po očkovaní mRNA boli podobné odpovediam IgG1 špecifickým pre hroty u jedincov, ktorí neboli infikovaní alebo ktorí boli infikovaní po očkovaní mRNA. To podporuje jav, že už existujúce pamäťové bunky IgG4 špecifické pre hroty B boli reaktivované v skupinách očkovaných mRNA, kde prvým stretnutím bola vakcína mRNA. Zdá sa, že vakcína mRNA používaná na imunizáciu je rozhodujúca pri vzniku vysokej distribúcie podtriedy IgG4 v sekundárnej imunitnej odpovedi. Tento jav bol opísaný aj v iných štúdiách14,15. Zaujímavé je, že podobný účinok primingu bol popísaný u detí očkovaných acelulárnym čiernym kašľom alebo celobunkovými vakcínami proti čiernemu kašľu. Tu u neočkovaných rekonvalescentných detí prevládali podtriedy IgG1 a IgG3 špecifické pre čierny kašeľ (PT), zatiaľ čo u detí očkovaných acelulárnymi vakcínami proti čiernemu kašľu boli vyrobené hlavne zdravé alebo prelomovo infikované, PT-špecifické podtriedy IgG1, IgG2 a IgG427.
Naše výsledky môžu naznačovať, že regulácia triedy B buniek špecifických pre hroty závisí od typu vakcíny (t.j. mRNA verzus vektor) a okolností prvého stretnutia s antigénom hrotu (očkovanie verzus infekcia). Okrem toho sa zdá, že sa prenáša na úrovni pamäťových B buniek, pretože infekcia pripomína IgG2 a IgG4 okrem odpovede IgG1 dlho po očkovaní mRNA.
Na rozdiel od iných podtried IgG má IgG4 imunosupresívne vlastnosti a predstavuje iba 4-5% celkového IgG. Jeho interakcia s molekulou C1q je slabšia ako interakcia ostatných podtried, preto nie je schopná aktivovať klasickú dráhu komplementu28. Vzhľadom na svoju nízku afinitu k C1q, ale všeobecne vysokú afinitu k antigénu, protilátky IgG4 pôsobia ako prirodzené blokujúce protilátky29. Doteraz len veľmi málo štúdií zaznamenalo očkovaním vyvolané reakcie IgG4 proti infekčným chorobám. Napríklad zvýšené hladiny IgG4 boli preukázané u detí, ktoré dostali opakované dávky acelulárnych očkovaní proti čiernemu kašľu na rozdiel od celobunkových vakcín proti čiernemu kašľu30,31. Počas vývoja vakcíny proti HIV však boli hlásené špecifické protilátky IgG432. Nedávna štúdia ukázala, že HIV-špecifické podtriedy IgG1 a IgG4 môžu byť použité na monitorovanie dlhodobých reakcií na kontrolu replikácie vírusu a eradikáciu infekcie HIV33. Je pozoruhodné, že špecifická podtrieda protilátok IgG4 sa môže objaviť po prirodzených infekciách, ako je infekcia vírusom osýpok34.
Konvenčný adenovírusový (Ad) vektor je replikačný neobalený dvojvláknový DNA vírus s transgénovou expresiou až 7,5 kb35. Vektory reklamy môžu aktivovať vrodenú imunitu, zatiaľ čo sú rozpoznané mýtnymi receptormi (TLR), ako sú TLR9, TLR2 a TLR4. Je tiež známe, že hladiny IgG3 špecifické pre rekombinantný proteín boli nižšie u myší TLR4-knockout (KO) po intravenóznej injekcii vektorov Ad. V inej štúdii boli rekombinantné proteíny špecifické IgM, IgG2, IgG3 a IgA tiež downregulované u myší TLR2 KO36. Keďže mRNA sú veľmi veľké a vysoko negatívne nabité molekuly, technológia vakcín využíva nosný systém lipidových nanočastíc (LNP), ktorý uľahčuje ich vstup do buniek endocytózou. Hlavnou zložkou LNP sú polyetylénglykolylované lipidy, ktoré znižujú agregáciu a zvyšujú biologické polčasy vakcín. S nimi však bolo spojených niekoľko nevýhod, ako napríklad zvýšená imunogenita37,38,39. mRNA vakcíny môžu tiež stimulovať vrodenú imunitu rozpoznaním TLR7 alebo TLR8 v endozómoch na stimuláciu produkcie interferónu typu I a prozápalových cytokínov. Okrem toho stimulácia intracelulárnych TLR3, TLR7 a TLR9 v B bunkách môže viesť k generácii IgG1 a IgG4 pozitívnych pamäťových B buniek40. Na zníženie potenciálneho škodlivého účinku mRNA Karikó et al. nahradili uridín pseudouridínom, čo viedlo k molekulám mRNA, ktoré neboli imunogénne a mali zvýšenú translačnú kapacitu41. Ešte viac HPLC purifikácie modifikovaných mRNA viedlo k zníženiu indukcie interferónov typu I a prozápalových cytokínov42.
Okrem toho sa po alergén-špecifickej imunoterapii môžu objaviť vysoké hladiny expresie IgG443 alebo pri niekoľkých typoch rakoviny44, ktorý je prospešný pri alergických ochoreniach, ale môže naznačovať zhoršenú humorálnu imunitu voči nádorom. Pred pandémiou COVID-19 bola technológia mRNA väčšinou vyvinutá ako nová liečba rakoviny. Pre liečbu rakoviny, ako je melanóm, glioblastóm, kolorektálny karcinóm, a rakovina prostaty; kandidátske vakcíny mRNA sú stále v klinických skúškach45. Imunitná pamäť a tvorba špecifických protilátok s prepínaním tried závisia hlavne od odpovedí T-buniek. Robustná a pretrvávajúca odpoveď folikulárnych pomocných T-buniek (Tfh) bola popísaná aj v lymfatických uzlinách jedincov očkovaných vakcínou Pfizer-BioNTech46. Ďalšia analýza Tfh buniek v lymfatických uzlinách môže hrať kľúčovú úlohu v účinnosti očkovania založeného na mRNA.
Závery
Celkovo sú naše údaje, ktoré tu prezentujeme, veľmi relevantným potvrdením predchádzajúcich zistení, že mRNA vakcinácia vyvoláva vysoký podiel reakcií na IgG4 protilátky špecifické pre hrot. Naopak, u jedincov očkovaných mRNA vakcínami po infekcii SARS-CoV-2, ako aj u nativných jedincov očkovaných vakcínami na báze vektorov sa nevyvinula významná odpoveď špecifická pre hrot IgG4. Na objasnenie významu našich zistení pre budúci vývoj vakcín na báze mRNA sú potrebné ďalšie štúdie.
Materiály a metódy
Dostupnosť materiálov
Použité protilátky, komerčné skúšky a ďalšie použité činidlá sú zhrnuté v tabuľke 3. Ďalšie informácie o zdrojoch a činidlách možno získať od príslušného autora.Tabuľka 3 Kľúčové zdroje.
Očkovaná kohorta
Celá očkovaná kohorta pozostávala zo vzoriek od 47 zdravých dobrovoľníkov, z ktorých všetci boli pozitívni na protilátky IgG špecifické pre hroty. Skupiny INF → mRNA (infikované pred očkovaním mRNA) (a) a mRNA → INF (infikované po očkovaní mRNA) (b) obsahovali 13 a 5 subjektov. Skupina mRNA/no INF (neinfikované očkovanie mRNA) (c) zahŕňala 18 jedincov, ktorí neboli infikovaní vôbec, zatiaľ čo skupina Vector/no INF (neinfikované vektorové očkovanie) (d) zahŕňala 11 dobrovoľníkov s vektorovými vakcínami a bez predchádzajúcej infekcie (obr. 1). Vzorky plazmy boli odobraté po podaní 2-dávkovej primárnej a 1-dávkovej posilňovacej vakcíny v medián dňa 135 [medzikvartilový rozsah (IQR) 112–161]. Jeden dobrovoľník zo skupiny INF → mRNA dostal iba 2-dávkovú primárnu vakcínu. Vylučovacie kritériá v skupinách mRNA/no INF a Vector/no INF zahŕňali prítomnosť hladín IgG špecifických pre nukleokapsidy. Hladiny IgG špecifické pre nukleokapsidy v očkovanej kohorte sú uvedené v doplnku (obr. S2).
Jedinci v skupinách očkovaných mRNA dostali dve primárne imunizácie vakcínami BNT162b2 (Pfizer-BioNTech, New York, NY, USA) alebo mRNA-1273 (Moderna, Massachusetts, MA, USA). Skupina Vector/no INF bola imunizovaná buď nereplikujúcim sa vírusovým vektorom ChAdOx1 (AstraZeneca, Cambridge, UK) alebo Sputnikom V (rAd26-S/rAd5.S, Gamaleya National Research Center, Moskva, Rusko). Treťou posilňovacou dávkou vakcín boli homológne alebo heterológne vakcíny, ako sú vakcíny Pfizer-BioNTech, Moderna, Janssen (Ad26.COV2.S, Johnson&Johnson, New Brunswick, NJ, USA) alebo inaktivovaný vírus BBIBP-CorV (Sinopharm, Covilo, China National Biotec Group, Peking, Čína).
V následnej časti štúdie bolo sledovaných 15 zdravých darcov, ktorí patrili do skupín INF → mRNA (g), mRNA → INF (h) alebo mRNA/no INF (i) očkovacej kohorty po posilňovacích očkovaniach v medián dní 37 [(IQR) 20–60] a 160 [(IQR) 125–173] (obr. 1). Títo jedinci boli imunizovaní dvoma dávkami vakcín mRNA, ako sú Pfizer-BioNTech alebo Moderna, a treťou homológnou alebo heterológnou (Janssen alebo Sinopharm) posilňovacou vakcínou. Infekcie jedincov, ktorí boli infikovaní po očkovaní mRNA, sa vyskytli medzi dvoma časovými bodmi odberu vzoriek.
Kohorta COVID-19
Naša prierezová časť štúdie zahŕňala 26 ambulantných pacientov (CONV), ktorí sa dobrovoľne prihlásili na darovanie plazmy rekonvalescentov po infekcii SARS-CoV-2 a 101 hospitalizovaných pacientov s COVID-19 (HOSP) s aspoň jedným pozitívnym qRT-PCR zo vzorky výteru z nosohltanu. Závažnosť ochorenia sa hodnotila podľa usmernení WHO v čase odberu vzoriek. Tridsať hospitalizovaných pacientov nepotrebovalo kyslíkovú podporu (kategória 3 WHO), 36 hospitalizovaných pacientov dostalo podporu nosového kyslíka (WHO kategória 4) a 35 kriticky chorých pacientov vyžadovalo intenzívnu starostlivosť (kategória WHO kritická 6, 7 a smrteľná 8). Analyzovali sme 22 osôb (e) zo skupiny CONV a 56 pacientov (f) zo skupiny HOSP. Štyri osoby a 45 pacientov bolo vylúčených, pretože ich hladiny IgG proti SARS-CoV-2 neboli merateľné komerčne dostupnou anti-SARS-CoV IgG súpravou (generické testy CoV-2 IgG). Štúdiu schválila Maďarská agentúra pre etické preskúmanie (ETT-TUKEB; Nie. IV/4403-2/2020/EKU). Písomný informovaný súhlas bol získaný od pacienta alebo najbližších príbuzných v súlade s Helsinskou deklaráciou. Vzorky boli odobraté v prvej epidemickej vlne, keď pacienti ešte neboli očkovaní proti SARS-CoV-2. V našej kohorte pacientov s COVID-19 bol ťažký akútny respiračný syndróm spojený s častým výskytom diabetes mellitus a malígnych ochorení (p < 0,0001). Pacienti, ktorí zomreli neskôr, mali štyri komorbidity, zatiaľ čo tí, ktorí prežili, mali len dve. Zvýšený počet komplikácií v nemocnici, ako je zápal pľúc, respiračné zlyhanie, sepsa, tromboembolické príhody a akútne poškodenie obličiek, bol častejší u tých, ktorí vyžadovali liečbu JIS alebo zomreli (p < 0,0001)47.
Meranie celkových protilátok SARS-CoV-2 IgG špecifických pre hroty a nukleokapsidy
IgG protilátky proti SARS-CoV-2 spike (S) a nukleokapsidovým (N) proteínom boli detegované pomocou komerčne dostupných testov (GA Generic Assay GmbH, Nemecko). Medzná hodnota (Co) a index väzby (BI) boli vypočítané podľa pokynov výrobcu [medzná hodnota (Co) = 0,250 + ODNegatívna kontrola, BI = vzorka OD/Co]. Vzorky s BI vyšším ako 0,9 boli považované za pozitívne.
Stanovenie celkového IgG špecifického pre hroty interným testom ELISA
Interné testy ELISA boli vykonané s rekombinantným proteínom SARS-CoV-2 s hrotom (S) v plnej dĺžke (systémy výskumu a vývoja, Minneapolis, USA). Stručne povedané, rekombinantný proteín S bol cez noc potiahnutý na 96-jamkových polystyrénových mikrotitračných platniach (Greiner Bio-One GmbH, Rakúsko) v koncentrácii 1 μg/ml v 100 μl povlakového bikarbonátového tlmivého roztoku (pH 9,8) pri teplote 4 °C. Po zablokovaní 1% hovädzím sérovým albumínom (BSA) sme platničky dôkladne umyli fosfátovým soľným roztokom (PBS)-Tween. Pacientske a kontrolné séra boli zriedené v pomere 1:25 a naložené na platne v duplikátoch. Platničky boli ďalej inkubované pri izbovej teplote počas 1 hodiny a vyvinuté s HRP-značenou kozou antihumánnou IgG sekundárnou protilátkou (SouthernBiotech, USA). Hodnoty absorbancie vzoriek a pozitívne a negatívne kontroly boli merané pri 450 nm pri referenčnej vlnovej dĺžke 620 nm pomocou automatizovanej čítačky doštičiek (Tecan Group Ltd, Švajčiarsko). Medzné hodnoty boli určené strednou hodnotou plus dvojnásobok smerodajnej odchýlky (SD) negatívnej kontroly.
Stanovenie každej podtriedy IgG špecifickej pre hroty internou analýzou ELISA
Podrobné protokoly už boli opísané48. Stručne povedané, rekombinantné plnohodnotné spike proteíny a kalibrátory purifikovaných ľudských protilátok podtriedy IgG1 (od 2000 do 15,6 ng/ml) a IgG2, 3, 4 podtriedy (v rozmedzí od 1000 do 15,6 ng/ml) (abcam, Cambridge, UK) boli cez noc potiahnuté 96-jamkovými polystyrénovými platňami (Greiner Bio-One GmbH). Po zablokovaní sme na platňu pridali vzorky séra v riedeniach medzi 1:25 a 1:250 a inkubovali pri izbovej teplote počas 1 hodiny. Viazané protilátky sa potom zistili s HRP-konjugovanými protilátkami proti človeku špecifickými pre podtriedu.
Stanovenie celkového sérového IgG a celkového sérového IgG podtried nefelometriou
Koncentrácie celkových sérových (nielen hrotovo špecifických) podtried IgG a IgG1–4 boli merané nefelometrickým testom s použitím systémového analyzátora BN™ II (Siemens Healthcare GmbH, Erlangen, Nemecko). Ďalej používame termíny celkové sérum IgG a celkové sérum IgG1–4 podtriedy. Siemens N Antisera na ľudské IgG, Siemens N AS IgG1/IgG2 a Siemens N Latex IgG3/IgG4 boli použité podľa pokynov výrobcu.
Percentuálny podiel každej podtriedy IgG špecifickej pre hroty vo vzťahu k súčtu všetkých hladín IgG špecifických pre hroty v očkovanej kohorte a kohorte COVID-19 bol určený nasledujúcim spôsobom. Po prvé, percentuálne podiely podtried IgG boli vypočítané pre každého jednotlivca vydelením úrovne každej podtriedy IgG špecifickej pre hroty súčtom úrovní všetkých špecifických podtried. Potom boli vypočítané priemerné percentá jednotlivcov pre každú podtriedu IgG v príslušnej skupine.
Štatistické metódy
Štatistické analýzy boli vykonané pomocou GraphPad Prism (GraphPad Software v9.0, San Diego, Kalifornia, USA). Väčšina premenných nevykazovala normálne rozdelenia; preto sú údaje prezentované ako mediány a medzikvartilové (IQ) rozsahy. Použili sa neparametrické štatistické testy, ako napríklad Mann-Whitneyho test pre dvoch a Kruskal-Wallisov test s Dunnovým post hoc testom pre viaceré nezávislé skupiny. Hodnoty P < 0,05 W Považuje sa za štatisticky významné.
References
- Fiolet, T., Kherabi, Y., MacDonald, C. J., Ghosn, J. & Peiffer-Smadja, N. Comparing COVID-19 vaccines for their characteristics, efficacy and effectiveness against SARS-CoV-2 and variants of concern: A narrative review. Clin. Microbiol. Infect. 28, 202–221. https://doi.org/10.1016/j.cmi.2021.10.005 (2022).Article CAS PubMed Google Scholar
- Chung, Y. H., Beiss, V., Fiering, S. N. & Steinmetz, N. F. COVID-19 vaccine frontrunners and their nanotechnology design. ACS Nano 14, 12522–12537. https://doi.org/10.1021/acsnano.0c07197 (2020).Article CAS PubMed Google Scholar
- Horvath, J. K. et al. Real-time monitoring of the effectiveness of six COVID-19 vaccines against laboratory-confirmed COVID-19 in Hungary in 2021 using the screening method. Vaccines 10, 824. https://doi.org/10.3390/vaccines10111824 (2022).Article CAS Google Scholar
- Lozano-Ojalvo, D. et al. Differential effects of the second SARS-CoV-2 mRNA vaccine dose on T cell immunity in naive and COVID-19 recovered individuals. Cell Rep. 36, 109570. https://doi.org/10.1016/j.celrep.2021.109570 (2021).Article CAS PubMed PubMed Central Google Scholar
- Ebinger, J. E. et al. Antibody responses to the BNT162b2 mRNA vaccine in individuals previously infected with SARS-CoV-2. Nat. Med. 27, 981–984. https://doi.org/10.1038/s41591-021-01325-6 (2021).Article CAS PubMed PubMed Central Google Scholar
- Astakhova, E. A. et al. Functional profiling of in vitro reactivated memory B cells following natural SARS-CoV-2 infection and gam-COVID-vac vaccination. Cells 11, 1991. https://doi.org/10.3390/cells11131991 (2022).Article CAS PubMed PubMed Central Google Scholar
- Zhang, Z. et al. Humoral and cellular immune memory to four COVID-19 vaccines. Cell 185, 2434–2451. https://doi.org/10.1016/j.cell.2022.05.022 (2022).Article CAS PubMed PubMed Central Google Scholar
- Vidarsson, G., Dekkers, G. & Rispens, T. IgG subclasses and allotypes: From structure to effector functions. Front. Immunol. 5, 520. https://doi.org/10.3389/fimmu.2014.00520 (2014).Article CAS PubMed PubMed Central Google Scholar
- Gregorek, H. et al. The IgG subclass profile of anti-HBs response in vaccinated children and children seroconverted after natural infection. Vaccine 18, 1210–1217. https://doi.org/10.1016/s0264-410x(99)00394-1 (2000).Article CAS PubMed Google Scholar
- Damelang, T., Rogerson, S. J., Kent, S. J. & Chung, A. W. Role of IgG3 in infectious diseases. Trends Immunol. 40, 197–211. https://doi.org/10.1016/j.it.2019.01.005 (2019).Article CAS PubMed Google Scholar
- Hjelholt, A., Christiansen, G., Sorensen, U. S. & Birkelund, S. IgG subclass profiles in normal human sera of antibodies specific to five kinds of microbial antigens. Pathog. Dis. 67, 206–213. https://doi.org/10.1111/2049-632X.12034 (2013).Article CAS PubMed Google Scholar
- Palgen, J. L. et al. Optimize prime/boost vaccine strategies: Trained immunity as a new player in the game. Front. Immunol. 12, 612747. https://doi.org/10.3389/fimmu.2021.612747 (2021).Article CAS PubMed PubMed Central Google Scholar
- Goel, R. R. et al. Longitudinal analysis reveals distinct antibody and memory B cell responses in SARS-CoV2 naive and recovered individuals following mRNA vaccination. MedRxiv. https://doi.org/10.1101/2021.03.03.21252872 (2021).Article PubMed PubMed Central Google Scholar
- Irrgang, P. et al. Class switch towards non-inflammatory, spike-specific IgG4 antibodies after repeated SARS-CoV-2 mRNA vaccination. Sci. Immunol. https://doi.org/10.1126/sciimmunol.ade2798 (2022).Article PubMed Central Google Scholar
- Buhre, J. S. et al. mRNA vaccines against SARS-CoV-2 induce comparably low long-term IgG Fc galactosylation and sialylation levels but increasing long-term IgG4 responses compared to an adenovirus-based vaccine. Front. Immunol. 13, 1020844. https://doi.org/10.3389/fimmu.2022.1020844 (2022).Article CAS PubMed Google Scholar
- Cosentino, M. & Marino, F. Understanding the pharmacology of COVID-19 mRNA vaccines: Playing dice with the spike?. Int. J. Mol. Sci. 23, 10881. https://doi.org/10.3390/ijms231810881 (2022).Article CAS PubMed PubMed Central Google Scholar
- van den Hoogen, L. L. et al. SARS-CoV-2 spike S1-specific IgG kinetic profiles following mRNA or vector-based vaccination in the general Dutch population show distinct kinetics. Sci. Rep. 12, 5935. https://doi.org/10.1038/s41598-022-10020-6 (2022).Article ADS CAS PubMed PubMed Central Google Scholar
- Santotoribio, J. D. et al. Clinical evaluation of serum levels of SARS-CoV-2 anti-spike protein IgG antibodies in infected patients and vaccinated subjects. Clin. Lab. 68, 1101. https://doi.org/10.7754/Clin.Lab.2021.211101 (2022).Article Google Scholar
- Nirula, A., Glaser, S. M., Kalled, S. L. & Taylor, F. R. What is IgG4? A review of the biology of a unique immunoglobulin subtype. Curr. Opin. Rheumatol. 23, 119–124. https://doi.org/10.1097/BOR.0b013e3283412fd4 (2011).Article CAS PubMed Google Scholar
- Luo, H. et al. The characterization of disease severity associated IgG subclasses response in COVID-19 patients. Front. Immunol. 12, 632814 (2021).Article CAS PubMed PubMed Central Google Scholar
- Stavnezer, J., Guikema, J. E. & Schrader, C. E. Mechanism and regulation of class switch recombination. Annu. Rev. Immunol. 26, 261–292. https://doi.org/10.1146/annurev.immunol.26.021607.090248 (2008).Article CAS PubMed PubMed Central Google Scholar
- Chu, T. H., Patz, E. F. Jr. & Ackerman, M. E. Coming together at the hinges: Therapeutic prospects of IgG3. MAbs 13, 1882028. https://doi.org/10.1080/19420862.2021.1882028 (2021).Article CAS PubMed PubMed Central Google Scholar
- Laidlaw, B. J. & Ellebedy, A. H. The germinal centre B cell response to SARS-CoV-2. Nat. Rev. Immunol. 22, 7–18. https://doi.org/10.1038/s41577-021-00657-1 (2022).Article CAS PubMed Google Scholar
- Inoue, T. & Kurosaki, T. Memory B cells. Nat. Rev. Immunol. https://doi.org/10.1038/s41577-023-00897-3 (2023).Article PubMed Google Scholar
- Ausiello, C. M., Urbani, F., la Sala, A., Lande, R. & Cassone, A. Vaccine- and antigen-dependent type 1 and type 2 cytokine induction after primary vaccination of infants with whole-cell or acellular pertussis vaccines. Infect. Immun. 65, 2168–2174. https://doi.org/10.1128/iai.65.6.2168-2174.1997 (1997).Article CAS PubMed PubMed Central Google Scholar
- Roltgen, K. et al. Immune imprinting, breadth of variant recognition, and germinal center response in human SARS-CoV-2 infection and vaccination. Cell 185, 1025–1040 (2022).Article CAS PubMed PubMed Central Google Scholar
- Giammanco, A. et al. Analogous IgG subclass response to pertussis toxin in vaccinated children, healthy or affected by whooping cough. Vaccine 21, 1924–1931. https://doi.org/10.1016/s0264-410x(02)00823-x (2003).Article CAS PubMed Google Scholar
- Aalberse, R. C., Stapel, S. O., Schuurman, J. & Rispens, T. Immunoglobulin G4: An odd antibody. Clin. Exp. Allergy 39, 469–477. https://doi.org/10.1111/j.1365-2222.2009.03207.x (2009).Article CAS PubMed Google Scholar
- Bianchini, R., Karagiannis, S. N., Jordakieva, G. & Jensen-Jarolim, E. The role of IgG4 in the fine tuning of tolerance in IgE-mediated allergy and cancer. Int. J. Mol. Sci. 21, 45017. https://doi.org/10.3390/ijms21145017 (2020).Article CAS Google Scholar
- Hendrikx, L. H. et al. Different IgG-subclass distributions after whole-cell and acellular pertussis infant primary vaccinations in healthy and pertussis infected children. Vaccine 29, 6874–6880. https://doi.org/10.1016/j.vaccine.2011.07.055 (2011).Article CAS PubMed Google Scholar
- van der Lee, S., Sanders, E. A. M., Berbers, G. A. M. & Buisman, A. M. Whole-cell or acellular pertussis vaccination in infancy determines IgG subclass profiles to DTaP booster vaccination. Vaccine 36, 220–226. https://doi.org/10.1016/j.vaccine.2017.11.066 (2018).Article CAS PubMed Google Scholar
- Mdluli, T. et al. RV144 HIV-1 vaccination impacts post-infection antibody responses. PLoS Pathog. 16, e1009101. https://doi.org/10.1371/journal.ppat.1009101 (2020).Article CAS PubMed PubMed Central Google Scholar
- Pastori, C. et al. Serum IgG1 and IgG4 could contribute to partial control of viral rebound in chronically HIV-1-infected patients. AIDS 35, 1549–1559. https://doi.org/10.1097/QAD.0000000000002944 (2021).Article PubMed Google Scholar
- Isa, M. B. et al. Comparison of immunoglobulin G subclass profiles induced by measles virus in vaccinated and naturally infected individuals. Clin. Diagn. Lab. Immunol. 9, 693–697. https://doi.org/10.1128/cdli.9.3.693-697.2002 (2002).Article CAS PubMed PubMed Central Google Scholar
- Marquez-Martinez, S., Vijayan, A., Khan, S. & Zahn, R. Cell entry and innate sensing shape adaptive immune responses to adenovirus-based vaccines. Curr. Opin. Immunol. 80, 102282. https://doi.org/10.1016/j.coi.2023.102282 (2023).Article CAS PubMed Google Scholar
- Sakurai, F., Tachibana, M. & Mizuguchi, H. Adenovirus vector-based vaccine for infectious diseases. Drug Metab. Pharmacokinet. 42, 100432 (2022).Article CAS PubMed Google Scholar
- Ibrahim, M. et al. Polyethylene glycol (PEG): The nature, immunogenicity, and role in the hypersensitivity of PEGylated products. J. Control Release 351, 215–230. https://doi.org/10.1016/j.jconrel.2022.09.031 (2022).Article CAS PubMed Google Scholar
- Fang, E. et al. Advances in COVID-19 mRNA vaccine development. Signal Transduct Target Ther. 7, 94. https://doi.org/10.1038/s41392-022-00950-y (2022).Article CAS PubMed PubMed Central Google Scholar
- Teijaro, J. R. & Farber, D. L. COVID-19 vaccines: Modes of immune activation and future challenges. Nat. Rev. Immunol. 21, 195–197. https://doi.org/10.1038/s41577-021-00526-x (2021).Article CAS PubMed PubMed Central Google Scholar
- Sackesen, C. et al. Suppression of B-cell activation and IgE, IgA, IgG1 and IgG4 production by mammalian telomeric oligonucleotides. Allergy 68, 593–603. https://doi.org/10.1111/all.12133 (2013).Article CAS PubMed Google Scholar
- Kariko, K. et al. Incorporation of pseudouridine into mRNA yields superior nonimmunogenic vector with increased translational capacity and biological stability. Mol. Ther. 16, 1833–1840. https://doi.org/10.1038/mt.2008.200 (2008).Article CAS PubMed Google Scholar
- Kariko, K., Muramatsu, H., Ludwig, J. & Weissman, D. Generating the optimal mRNA for therapy: HPLC purification eliminates immune activation and improves translation of nucleoside-modified, protein-encoding mRNA. Nucleic Acids Res. 39, e142. https://doi.org/10.1093/nar/gkr695 (2011).Article CAS PubMed PubMed Central Google Scholar
- Celebi Sozener, Z. et al. Tolerance mechanisms in allergen immunotherapy. Curr. Opin. Allergy Clin. Immunol. 20, 591–601 (2020).Article PubMed Google Scholar
- Karagiannis, P., Gilbert, A. E., Nestle, F. O. & Karagiannis, S. N. IgG4 antibodies and cancer-associated inflammation: Insights into a novel mechanism of immune escape. Oncoimmunology 2, e24889. https://doi.org/10.4161/onci.24889 (2013).Article PubMed PubMed Central Google Scholar
- Lorentzen, C. L., Haanen, J. B., Met, O. & Svane, I. M. Clinical advances and ongoing trials on mRNA vaccines for cancer treatment. Lancet Oncol. 23, e450–e458. https://doi.org/10.1016/S1470-2045(22)00372-2 (2022).Article CAS PubMed PubMed Central Google Scholar
- Mudd, P. A. et al. SARS-CoV-2 mRNA vaccination elicits a robust and persistent T follicular helper cell response in humans. Cell 185, 603–613. https://doi.org/10.1016/j.cell.2021.12.026 (2022).Article CAS PubMed Google Scholar
- Sinkovits, G. et al. Complement overactivation and consumption predicts in-hospital mortality in SARS-CoV-2 infection. Front. Immunol. 12, 663187. https://doi.org/10.3389/fimmu.2021.663187 (2021).Article CAS PubMed PubMed Central Google Scholar
- Sinkovits, G. et al. Concentration and subclass distribution of anti-ADAMTS13 IgG autoantibodies in different stages of acquired idiopathic thrombotic thrombocytopenic purpura. Front. Immunol. 9, 1646. https://doi.org/10.3389/fimmu.2018.01646 (2018).Article CAS PubMed PubMed Central Google Scholar
Acknowledgements
The authors acknowledge the technical assistance of Márta Kókai, Éva Zsuzsanna Szendrei, Lászlóné Kertész, Edina Szabó and Beáta Takács; clinical data by Marienn Réti, Veronika Müller, Zsolt Iványi, János Gál, László Gopcsa, Péter Reményi, Beáta Szathmáry, Botond Lakatos, János Szlávik, Ilona Bobek, Zita Z. Prohászka, Zsolt Förhécz, Tamás Masszi, and István Vályi-Nagy; the collection of samples by Dorottya Csuka, Lisa Hurler, Ágnes Szilágyi, Blanka Mező, Nóra Veszeli, Katalin Sz.M. Marossy, György Bihari, Kinga Szőcs and Rudolfné Holeczky with many thanks.
Funding
Open access funding provided by Semmelweis University. Project No. TKP2021-EGA-24 (MOLORKIV) has been implemented with the support provided by the Ministry of Innovation and Technology of Hungary from the National Research, Development and Innovation Fund, financed under the TKP2021-EGA funding scheme, by the Higher Education Institutional Excellence Program of the Ministry of Human Capacities in Hungary, within the framework of the molecular biology thematic program of Semmelweis University, and by the National Research, Development and Innovation Office (2020-1.1.6-JOVO-2021-00013 to ZP).
Author information
Authors and Affiliations
- Research Group for Immunology and Hematology, Semmelweis University-Eötvös Loránd Research Network (Office for Supported Research Groups), Budapest, 1085, HungaryPetra Kiszel, Erika Kajdácsi & Zoltán Prohászka
- Department of Internal Medicine and Hematology, Semmelweis University, Budapest, 1088, HungaryPál Sík, János Miklós, Erika Kajdácsi, György Sinkovits, László Cervenak & Zoltán Prohászka
Contributions
Design and excution of laboratory determinations: P.S., P.K., J.M., Collection and evaluation of clinical data: P.K., G.S., E.K., Statistical analysis and data interpretation: P.K., G.S. L.C., E.K., Z.P., Writing-Original Draft: P.K., G.S., L.C., Z.P., Writing-Review and Editing: all authors.
Pridaj komentár